Cara Mencari 4 Bilangan Kuantum

tentukan empat bilangan kuantum dari elektron terakhir untuk unsur X dengan nomor atom 38
Bilangan kuantum magnetik adalah bilangan kuantum yang menyatakan orientasi orbital dalam ruang tiga dimensi. Halaman all. Jawaban dari Soal "Tentukan Energi Foton dari Seberkas Cahaya" Skola. 11/01/2024, 19:30 WIB. 15 Syarat untuk Menjadi Pengawas TPS, Apa Saja? Skola. 11/01/2024, 14:11 WIB.

Tabel Bilangan Kuantum Ilmu
Contoh Soal Bilangan Kuantum dan Jawabannya. Untuk memperjelas atas materi diatas, berikut ini adalah contoh dengan bialngan kuantum. Antara lain; Jika suatu elektron dalam atom memiliki bilangan kuantum utama n = 4, maka tentukan bilangan kuantum azimuthnya!

Konsep Bilangan Kuantum, Cara Memahami dan menyusunnya SainsPedia
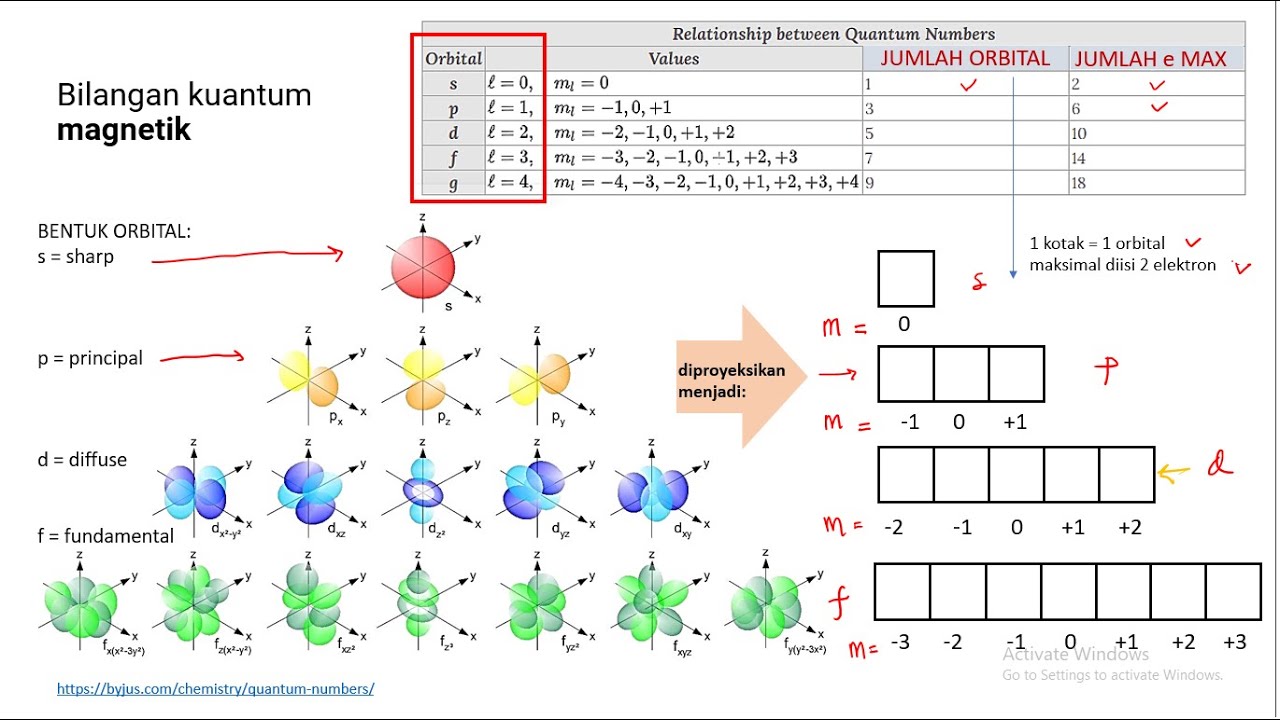
1. Bilangan kuantum utama. Disimbolkan dengan huruf (n) yang menyatakan tingkat energi. 2. Bilangan kuantum azimut atau momentum sudut. Disimbolkan (ℓ) yang menyatakan bentuk orbital. 3. Bilangan kuantum magnetik. Disimbolkan dengan huruf (m) yang menyatakan orientasi orbital dalam ruang tiga dimensi.

Cara mudah menentukan nomor atom dari bilangan kuantum Kimia SMA YouTube
Bilangan kuantum merupakan sebuah bilangan yang memiliki arti atau parameter khusus untuk menjelaskan sebuah keadaan sistem kuantum. Berikut penjelasannya.. Tentukan konfigurasi elektron dan diagram elektron dari atom unsur 32 Ge. Baca juga: Batas Wilayah Indonesia: Astronomis dan Geografis (LENGKAP) Beserta Penjelasan.
3 Bilangan Kuantum dan Konfigurasi Elektron Atom dan Sistem Periodik Unsur Kimia SMA X
Bilangan kuantum diwakili sebuah nilai yang menjelaskan kuantitas kekal dalam sistem dinamis. Bilangan kuantum menggambarkan sifat elektron dalam orbital. Selain itu, bilangan kuantum menyatakan tingkat energi utama, jarak dari inti, bentuk orbital, orientasi orbital, dan spin elektron.

Unsur X keempat bilangan kuantum pd elektron terakhir n=3 l=2 m=0 s=1/2, unsur X terletak pada
Tentukan bilangan kuantum utama, azimut, dan magnetik yang mungkin dimiliki oleh elektron yang menempati subtingkat energi 3d! Pembahasan: Subkulit 3d, berarti harga n = 3 dan l = 2. Jika l = 2 maka m = -2, -1, 0, +1, +2. Soal No. 4. Tuliskan semua bilangan kuantum untuk elektron yang terdapat pada tingkat energi L (n = 2)!

Cara mudah menentukan bilangan kuantum YouTube
#2: Tentukan Bilangan Kuantum Azimut (l) Bilangan kuantum azimut (l) ditentukan oleh bentuk orbital yang ditempuh oleh elektron dalam kulit atom. Nilai l berkisar antara 0 hingga (n-1). Misalnya, jika n = 3, maka nilai l bisa 0, 1, atau 2. Biasanya, nilai l diasosiasikan dengan huruf-huruf seperti s, p, d, atau f, yang mewakili bentuk orbital.

26++ Contoh Soal Tentang Bilangan Kuantum Utama Contoh Soal Terbaru
Yuk, belajar cara mencari bilangan kuantum dengan mudah melalui artikel Kimia kelas X berikut ini! —. Sadar nggak sih, kalau dunia kita ini penuh sekali akan berbagai hal yang teratur dengan rapi. Mulai dari matahari yang terbit dari arah Timur hingga terbenam ke arah Barat. Kemudian, ada bumi yang mengelilingi matahari dalam dua belas bulan.

Tentukan nilai bilangan kuantum n, l, m, dan s yang mungkin dari elektron yang menempati
Jika harga bilangan kuantum utama (n) = 3, maka harga bilangan kuantum azimuth (l) maksimum adalah = n-1 = 3-1 = 2. Oleh karena itu, bilangan kuantum n = 3, l = 3 pada option C tidak diizinkan. Contoh Soal 2. Suatu elektron memiliki harga bilangan kuantum utama (n) = 5. Tentukan bilangan kuantum yang lainnya! Pembahasan: Nilai n = 5

Elektron terakhir dari suatu atom x mempunyai bilangan kuantum sebagai berikut n=3 ; l=1 ; m=0
KOMPAS.com - Dalam pelajaran unsur kimia, terdapat sub-bab tentang bilangan kuantum. Hal tersebut terangkum dalam tulisan berikut: Tentukanlah bilangan kuantum elektron terakhir dari unsur-unsur dibawah ini: a. 17Cl b. 26Fe c. 27Co d. 28Ni e. 31Ga f. 35Br. Jawaban: a. Tentukan konfigurasi atom klorin untuk menentukan bilangan kuantum elektron.

BILANGAN KUANTUM YouTube
Pertama-tama kita tentukan konfigurasi elektronnya untuk mengetahui letak elektron terakhir masing-masing: (a) 18A : [Ne]3s23p6. Elektron terakhir pada 3p6 dengan diagram orbital: Sehingga keempat bilangan kuantumnya ( n, l, m, s) adalah 3, 1, 1, -1/2. (b) 27B : [Ar]4s23d7. Elektron terakhir pada 3d7, diagram orbital.

tentukan bilangan kuantum dari unsur dan ionion pada a. 14 si b. 26fe c. 37Rb d. 50 SN e. 31ga3
Bilangan kuantum utama (n) mendeskripsikan ukuran dan tingkat energi orbital. Semakin besar nilai n, maka semakin besar ukuran orbital dan semakin tinggi tingkat energinya.. Contoh Soal Bilangan Kuantum. Tentukan konfigurasi elektron dan diagram elektron dari atom unsur dan ion monoatomik berikut. a. 27 Co. b. 32 Ge. c. 20 Mg 2+ d.

tentukan keempat bilangan kuantum untuk elektron terakhir dari 13Al Brainly.co.id
25 Juni 2023 Mamikos. Bagikan. Cara Mencari Bilangan Kuantum dan Contoh Soal Lengkap - Untuk mempermudah pengertian tentang bilangan kuantum, kamu bisa mengingat bagaimana planet-planet di tata surya mengelilingi matahari dengan teratur. Anggap saja matahari itu atom, sementara planet-planetnya adalah elektron dengan energi tertinggi.

Kimia bilangan kuantum utama, azimut, dan spin YouTube
Video penjelasan cara menentukan bilangan kuantum suatu elektron, kuantum utama (n), kuantum azimut (l), kuantum magnetik (m), dan kuantum spin (s).#bilangan.

Konsep Bilangan Kuantum, Cara Memahami dan menyusunnya Sains Pedia
Silahkan tentukan bilangan kuantum utama, azimut dan magnetik? Jawab: n = 4 l = 3 Ketika l = 2, maka dapat ditentukan nilai m = -3-2, -1, 0, +1, +2+3. fb Whatsapp Twitter LinkedIn. Tags Bilangan Kuantum, ilmu kimia; Related Posts. Polisakarida: Pengertian - Fungsi dan Strukturnya;

Cara Menentukan Bilangan Kuantum Elektron Terakhir dari Unsur Besi (26Fe) Mekanika Kuantum
Tentukan bilangan kuantum dari: 40 Zr. 1. Buat dulu konfigurasi elektronnya. 40 Zr = 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 2. 2. Keempat bilangan kuantum ditentukan dari konfigurasi elektron terakhir, yaitu 4d 2. 3. Karena Tingkat energi pada konfigurasi terakhir adalah 4, maka bil.kuantum utama (n) = 4. 4.